筋トレの分子生物学シリーズ第 5 弾.筋収縮の主体であるアクチンとミオシンについて.タイチンについて最近分かってきた点にも言及する.山本義徳オフィシャルブログは学術的にも詳細なことで有名であるが, 2018 年 9 月 27 日時点では,タイチンについては古い学説のままである.
細胞骨格
細胞の形態を維持している蛋白質には 3 種類あり,細胞骨格と呼ばれる.微小管,アクチンフィラメント,中間径フィラメントである.
中間径フィラメントは比較的丈夫なロープ状の構造で,曲げやすく切れにくい性質を持っている.微小管は丈夫で硬い中空構造をしている.アクチンフィラメントは最も細く,伸びにくく,切れやすい性質を持っている.
アクチンフィラメントは架橋蛋白により様々な構造を取るが,筋細胞においては α アクチニンにより比較的ゆるく架橋されており,II 型ミオシンが入り込む隙間を作っている.
ミオシン滑走説
アクチンとミオシンの ATP 加水分解に伴う力発生の物理的原理は分かっていないが,様々な状況証拠からミオシン滑走説が支持されている.
ミオシン頭部は ATP を結合して加水分解し,そのエネルギーを用いてアクチンフィラメント上を移動する.ミオシンの三次元構造を調べてみると,ミオシン頭部は可動腕,変換ドメイン,ATP 結合部位,アクチン結合部位からなる.変換ドメインは ATP 加水分解を構造変化に変換する機構で ATP の末端リン酸基の有無に応じて比較的小規模の構造変化が増幅され,別領域の回転運動を起こす.ミオシンは可動腕の首振りによってアクチンに沿って一歩進む.ミオシンの構造変化はアクチン結合部位の結合親和性を変化させ,ミオシン頭部はアクチンから離れて違う箇所に結合する.この結合が共有結合なのか非共有結合なのかは分かっていない.
ミオシンは多数のモーター頭部が同じアクチンフィラメントに作用する配置を取り,1 回のサイクルでモーター蛋白は 5 nm 移動する.アクチンとミオシンの結合と解離は 1 秒間に約 5 回起こり,滑走速度は毎秒 15 µm になる.一つのサルコメアが 1 サイクルで短縮する長さは僅かだが,サルコメアは直列に配置しており,筋細胞全体,筋肉全体が一斉に同期して収縮すると大きな力を発生する.
©Essential Cell Biology
収縮の開始
T 管の膜にある電位依存性 Ca2+ チャネルが活動電位によって活性化すると,筋小胞体の Ca2+ 放出チャネルが開き,細胞質に大量の Ca2+ が流入して筋原線維の収縮が始まる.
トロポミオシン,トロポニン複合体および Ca2+
静止状態のアクチンフィラメントにはトロポミオシンが巻きついており,アクチンのミオシン結合部位を塞いでいる.トロポミオシンにはトロポニン複合体が結合しており,Ca2+ が結合することでトロポミオシンの位置がずれ,アクチンとミオシンが結合出来るようになる.
収縮の終了
Ca2+ 濃度上昇は一時的で,Ca2+ は筋小胞体膜にある多数の ATP 依存性 Ca2+ ポンプの働きにより迅速に筋小胞体内へ戻される.Ca2+ 濃度が静止状態に戻るとトロポニンとトロポミオシンが元の位置に戻り,収縮は終了する.
©Essential Cell Biology
筋収縮における ATP 消費
筋収縮においては2つの過程で ATP を大量に消費する.一つはミオシンモータードメインの ATP アーゼの駆動するフィラメントの滑走であり,もう一つは筋小胞体の Ca2+ ポンプによる Ca2+ の汲み上げである.
タイチン
Winding filament 仮説
2012 年ごろまではタイチン分子の winding filament 仮説が支持されていた.アクティブストレッチ(エキセントリック収縮,伸張性収縮)ではアクティブ収縮(コンセントリック収縮,短縮性収縮)よりも強い力が出ることは経験的に知られていたが,その機序として有力な説がこれであった.
つまり,短縮性収縮の際にタイチンの PEVK ドメインがアクチンフィラメントの周囲に巻きつき,弾性ポテンシャルエナジーを分子内に蓄積する.伸張性収縮の際にはそのエネルギーを解放しつつ伸長するために,短縮性収縮よりも強い力を発揮するというものである.
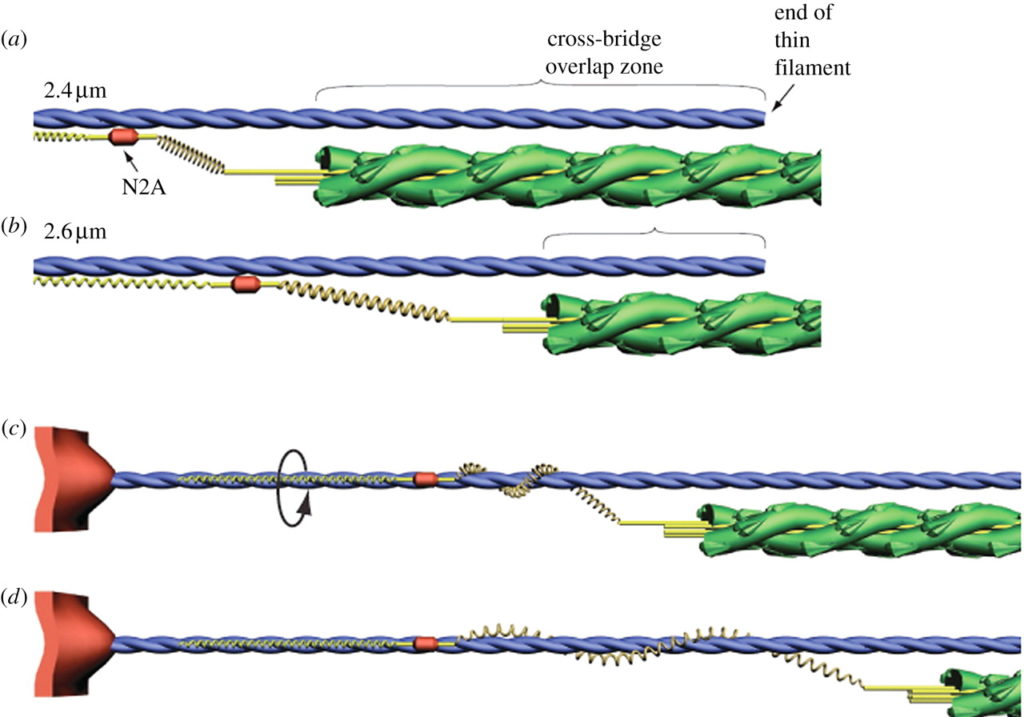
この仮説には一定の説得力があったものの, 2018 年時点ではもはや否定されつつある.というのも,最新の観測技術によりこの仮説を否定する結果が出てきたためである.
Titin folding 仮説
原子間力顕微鏡という機器がある.これは解像度がナノメートルという途方もない超高解像度の顕微鏡で,現在では静止画なら原子レベルの分解能がある.冒頭に示した動画は安藤敏夫らによるもので,高速原子間力顕微鏡により V 型ミオシン分子がアクチンフィラメント上を「歩く」様子を直接撮影したものである.コンピュータグラフィックスではない,本物の分子の挙動である.
この原子間力顕微鏡による観測により,筋収縮の際の詳細なタイチンの挙動が分かってきた.
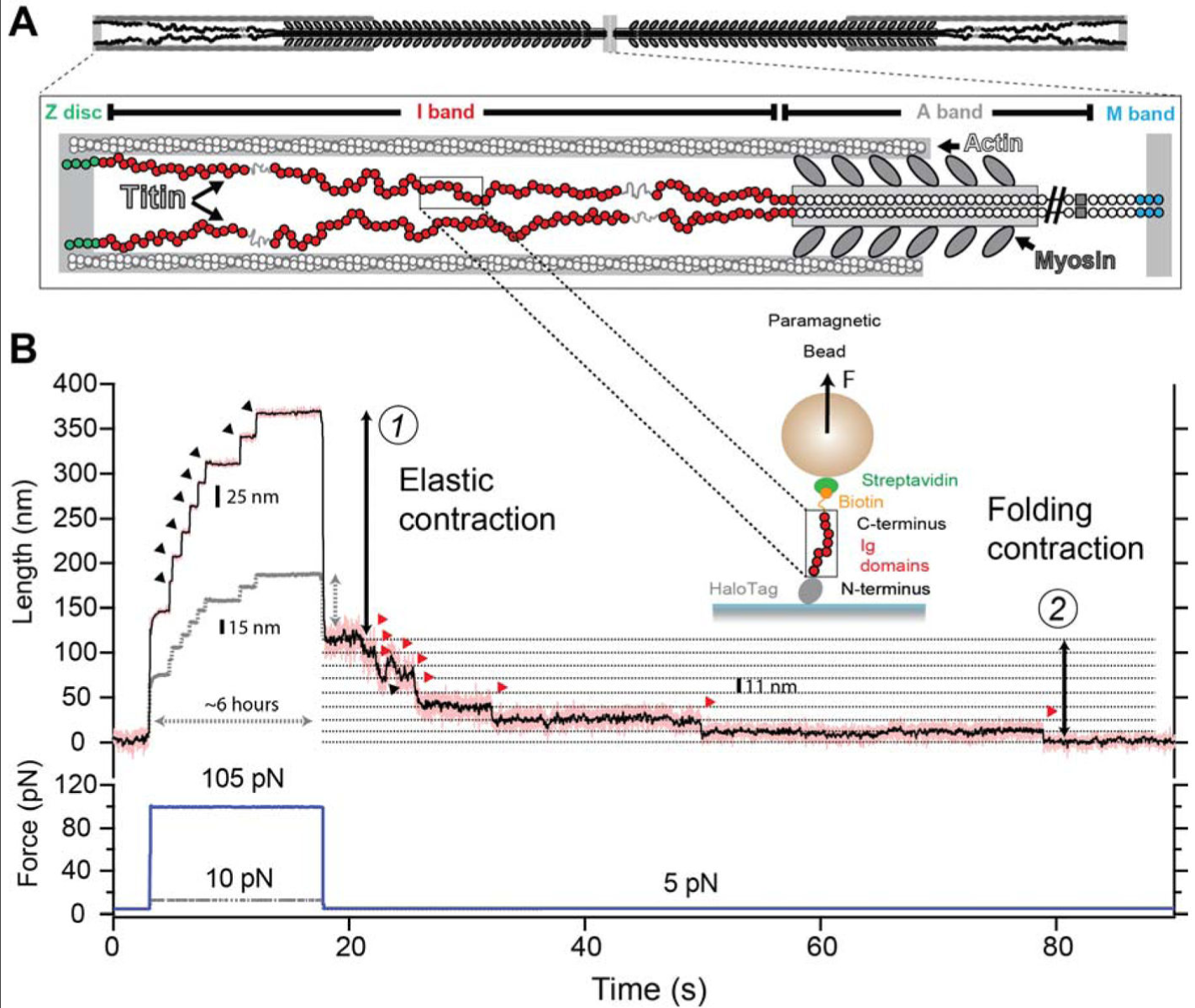
個々のタイチン分子を繰り返し引き伸ばし,加えた力を伸長の関数として記録したところ, 25-28 nm ごとに周期性のある鋸歯状パターンが現れた.個々の領域を展開するために必要な力は, 150-300 ピコニュートンの範囲であり,引っ張り速度に依存した.弛緩させると Ig ドメインの再折りたたみが観測された (Matthias Rief, Mathias Gautel, 1997).
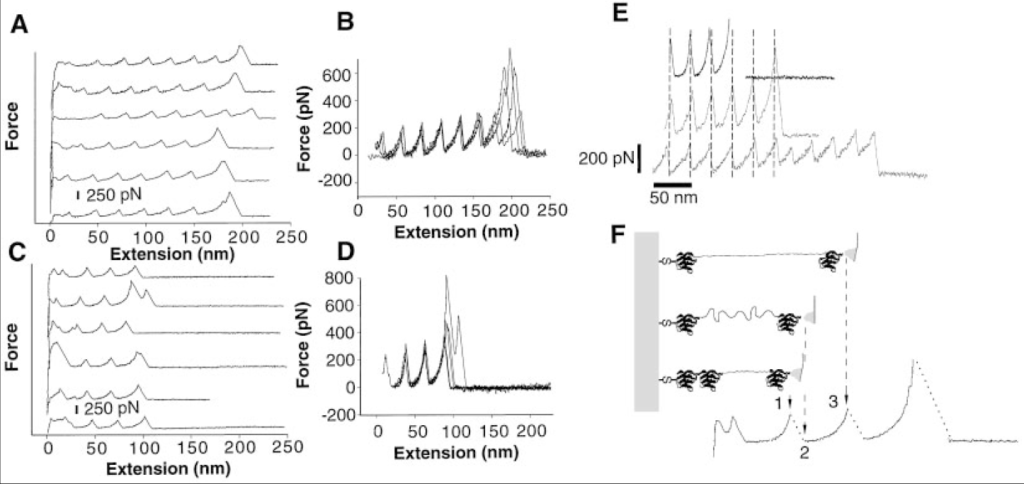
この周期性のある鋸歯状パターンは winding filament 仮説では説明がつかない.一本の長い分子が糸巻きのようにアクチンに巻き付いていくモデルでは鋸歯状のパターンは出現せず,滑らかな線形性を示すはずだからである.上の図の E が観測された結果であり,その結果 F のモデルが考えられた.これが titin folding 仮説である.
タイチンを引き伸ばす力が加わると, 150-300 ピコニュートンに達するごとに一つの折りたたまれた領域(Ig ドメイン)が引き伸ばされる(アンフォールディング).引き伸ばされると急激に収縮力を失うためにグラフが落ち込む.この 1 個あたりの長さが 25-28 nm である.次の折りたたみ領域に牽引力が集中し, 150-300 ピコニュートンに達するとそれが引き伸ばされる…その繰り返しである.
この折りたたみ領域の引き伸ばしはサルコメアが引き伸ばされる時に起きており,タイチン Ig ドメインの折りたたみ領域が引き伸ばされて弾性エネルギーを蓄積している.タイチン Ig ドメインは折りたたまれた状態がエネルギー準位として安定した状態であるため,外力がかからなくなると内部のエネルギーを捨てて折りたたんだ状態に戻ろうとする.そしてサルコメアにかかる牽引力が減少した際に引き伸ばされた領域が再度折りたたまれて(再フォールディング),蓄積された弾性エネルギーを解放するため,ミオシン単独よりも強い力を出すことができる.
蛋白質のフォールディング収縮という新しい発見は,次の三つの要素による.すなわち,静電相互作用,水素結合および疎水相互作用である.一旦アンフォールディングが起きると,そのポリペプチドはランダムコイルとなる.これは自由結合鎖モデルによく適合するが,ゴムバンドのような線形弾性とは対照的に,ポリマーのエントロピー反動は高度に非線形性である. Force clamp 法により明らかになったのは,モルテン・グロビュール遷移への折りたたみであり,疎水性残基の蛋白質コアへの隔離により駆動される.アンフォールドした蛋白質を牽引する力を「急停止」すると,その蛋白質はまず弾性収縮し,その後やや遅れて牽引力に抵抗して機械的仕事を行い,完全に折りたたまれた長さに短縮する.この時,水素結合ネットワークの再構築が起きている.

タイチンは,筋肉がミオシンの失速する力を超える負荷で働くことを可能にする
(A) 単分子研究からのミオシンモーターとタイチン Ig ドメインのエネルギー論の比較: 8 個までのミオシン頭部が光トラップ中のアクチンフィラメントを推進した実験からのデータは,ミオシンが 6 pN の負荷に対して失速していることを示している (82). そのデータは A.V.Hill の公式(緑色の曲線)に合致する.あるいは,タイチン Ig ドメインは 5.7 pN まで(青色曲線のピーク)の力で 46 zJ の仕事の最適な供給を達成する.したがって, 6-12 pN (灰色の陰影部分)の負荷では,ミオシンの出力がマイナスであるのに対して,タイチンフォールディングは有用な収縮の仕事を発生させることができる. (B) タイチンフォールディングによってミオシンモーターが前進する: (1) 筋肉が活性化される前にタイチンは 12 pN の受動的負荷全体を負担し,その結果, Ig ドメインのアンフォールディングが起こる. (2) カルシウムが放出されると,アクトミオシン架橋が形成されるが,そのモーターは失速しているため, 6 pN の力しか発生させることができない.しかし,モーターによって発生した力はタイチンドメインが受ける負荷を 6 pN に減少させ,結果として 10 nm までの再フォールディングステップをもたらす. (3) 蛋白質フォールディングのプロセスはタイチンフィラメントを短縮し,ミオシンモーターの負担を軽減してパワーストロークの完了を可能にする.このメカニズムから,タイチンは架橋形成なしでフォールディングすることができないだけでなく,パワーストロークの完了もまたタイチンフォールディングに依存することも明らかである.従って,タイミンとミオシンは、高い負荷に対してサルコメアを短縮するために手を携えて働く.
さらに精密な実験が行われ,タイチン Ig ドメインのセグメント 1 個あたりのフォールディング収縮の出力は 6 pN であること,ミオシンモーター 1 個あたりの出力も 6 pN であることが分かってきた(筋収縮における主要な駆動力としてのタイチン蛋白のフォールディングの働き).ただし,これらはすべて遺伝子組み換えタイチンの単分子の実験系であり,生体内で直接タイチンの挙動を観察・測定したものではない.
現実に筋細胞内で起きているアクチン,ミオシン,タイチンの挙動はまだ直接には観察されていない.単分子での挙動とシステムとしての分子複合体の挙動とが異なっている可能性もある.実際にミオシンモーターとタイチンとがどのような機序で作動しているのか,生体内で直接観測が可能になった時,筋収縮における分子レベルの理解が一定の段階に達するものと思われる.今後の研究が待たれる.